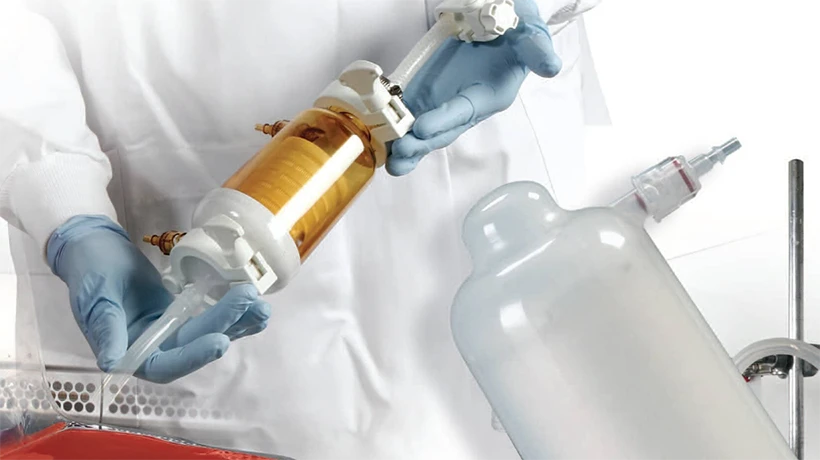
El proceso de prueba y verificación puede garantizar que los productos como los filtros plegables proporcionen un rendimiento preciso y confiable en el entorno de la industria, y cumplan con los estándares y especificaciones de equipos sanitarios nacionales y extranjeros.
- Hogar
- Productos

Proporcionamos un servicio todo en uno de la adquisición para los materiales y los accesorios sanitarios del filtro del grado, reduciendo sus costes de la adquisición.
Leer más - Industrias

Nos especializamos en proporcionar productos y servicios de filtración para las industrias de microelectrónica, biofarmacéutica y alimentos y bebidas con altas necesidades de higiene.
Leer másIndustrias - Aseguramiento de la calidad

La calidad es nuestra misión, y es nuestro deber asegurar que nuestros productos satisfagan las demandas de la industria.
Leer másAseguramiento de la calidad - Conocimiento

Proporcione pautas de selección de productos y servicios de conocimiento técnico para reducir sus costos de selección.
Leer másConocimiento - Acerca de

Bienvenido, somos un proveedor global de medios de filtración sanitaria y accesorios, que se especializa en el suministro de soluciones de filtración sanitaria.
Leer más - Contacto